Oba kemične spojine ker so kemični elementi sestavljeni iz molekul, ti pa iz atomov. Atomi ostanejo združeni zahvaljujoč tvorbi t.i. kemijske povezave.
The kemijske vezi niso enake: v osnovi so odvisne od elektronskih značilnosti vključenih atomov. Obstajata dve najpogostejši vrsti povezav: ionske vezi in kovalentne vezi.
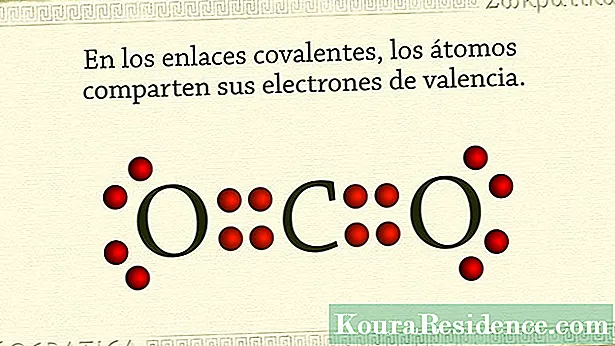
Običajno so kovalentne vezi tiste, ki držijo nekovinske atome skupaj. Zgodi se, da imajo atomi teh elementov v najbolj zunanji lupini veliko elektronov in se nagibajo k zadrževanju ali pridobivanju elektronov, namesto da bi se jim odpovedali.
Zato je način, kako te snovi ali kemične spojineicos doseže stabilnost z delitvijo para elektronov, une iz vsakega atoma. Na ta način je skupni par elektronov skupen obema atomoma in ju hkrati drži skupaj. V plini plemiči, na primer, to se zgodi. Tudi v halogenskih elementih.
Ko pride do kovalentne vezi med elementi s podobno elektronegativnostjo, kot med vodikom in ogljikom, nastane vez apolarni kovalent. To se na primer zgodi pri ogljikovodikih.
Prav tako vedno nastajajo homonuklearne molekule (sestavljene iz istega atoma) apolarne obveznice. Če pa pride do vezi med elementi z različno elektronegativnostjo, v enem atomu nastane večja gostota elektronov kot v drugem, zaradi česar nastane pol.
Tretja možnost je, da si dva atoma delita par elektronov, vendar te skupne elektrone prispeva le en atom. V tem primeru govorimo o dativna ali koordinatna kovalentna vez.
Za dativna povezava Potrebujete element s prostim elektronskim parom (na primer dušik) in element, ki mu primanjkuje elektronov (na primer vodik). Prav tako je treba, da je tisti z elektronskim parom dovolj elektronegativen, da ne izgubi elektronov, ki bi jih delili. To se zgodi na primer v amoniju (NH4+).
The snovi vsebujejo kovalentne spojine, se lahko pojavijo v katerem koli stanju snovi (trdnem, tekočem ali plinastem) in na splošno so slabi prevodniki toplote in električne energije.
Pogosto pokažejo razmeroma nizka tališča in vrelišča Y. so običajno topni v polarnih topilih, kot benzen ali ogljikov tetraklorid, vendar so slabo topni v vodi. So izredno stabilni.
Našteti so lahko številni primeri spojin ali snovi, ki vsebujejo kovalentne vezi:
- Fluor
- Brom
- Jod
- Klor
- Kisik
- Voda
- Ogljikov dioksid
- Amoniak
- Metan
- Propan
- Kremen
- Diamant
- Grafit
- Kremen
- Glukoza
- Parafin
- Dizel
- Dušik
- Helij
- Freon


